根据《医疗器械监督管理条例》(国务院令第680号)的规定,对医疗器械按照风险程度实行分类管理。
第Ⅲ类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械,无论境内、境外医疗器械生产企业均需要在NMPA进行注册。
CRO一站式服务
在湖南国瑞中安
根据《医疗器械监督管理条例》(国务院令第680号)的规定,对医疗器械按照风险程度实行分类管理。
第Ⅲ类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械,无论境内、境外医疗器械生产企业均需要在NMPA进行注册。
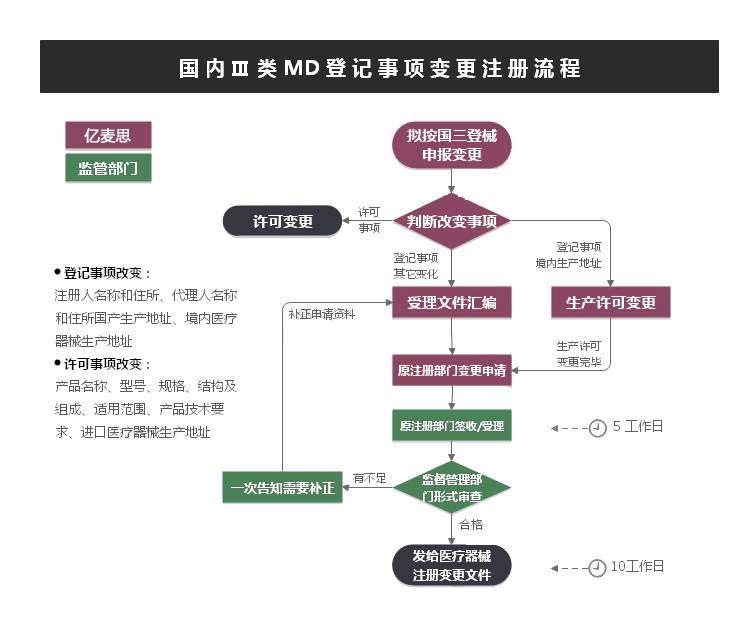
注册登记事项变更不收取变更注册申请费用。
文件名称 | 文号 |
《医疗器械监督管理条例》 | 国务院令第680号 |
《医疗器械注册管理办法》 | 国家食品药品监督管理总局令第4号 |
《医疗器械说明书和标签管理规定》 | 国家食品药品监督管理总局令第6号 |
《医疗器械临床试验质量管理规范》 | 国家食品药品监督管理总局令第25号 |
《医疗器械生产监督管理办法》 | 国家食品药品监督管理总局局令第37号 |
《医疗器械经营监督管理办法》 | 国家食品药品监督管理总局局令第37号 |
《医疗器械分类规则》 | 国家食品药品监督管理总局令第15号 |
《医疗器械临床试验质量管理规范》 | 国家食品药品监督管理总局令第25号 |
预算、合同、考虑期,1个月。
生产地址变化的,应提前准备变更生产许可证。
考虑变更资料准备,应当预计3~6个月。
登记变更无检测、无临床。
登记事项变更资料符合要求的,食品药品监督管理部门应当在10个工作日内发给医疗器械注册变更文件。
双方紧密配合,预算估计4~7个月。
NMPA II、III类医疗器械注册咨询;
NMPA 体外诊断试剂注册咨询;
NMPA 进口I、II、III类医疗器械注册咨询;
NMPA I类医疗器械备案办理咨询;
医疗器械优先审批办理咨询
创新医疗器械审批申请服务
欧盟CE(MDD、IVDD、PPE、AIMDD);
美国FDA(列名、510K、PMA);
全球注册(加拿大、澳大利亚、日本等)
体系建立\内审\运行\考核服务;
医疗器械临床试验服务;
注册、体系、临床培训服务;