《体外诊断试剂注册管理办法》所称的体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。可以单独使用,也可以与仪器、器具、设备或者系统组合使用。
CRO一站式服务
在湖南国瑞中安
《体外诊断试剂注册管理办法》所称的体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。可以单独使用,也可以与仪器、器具、设备或者系统组合使用。
免费
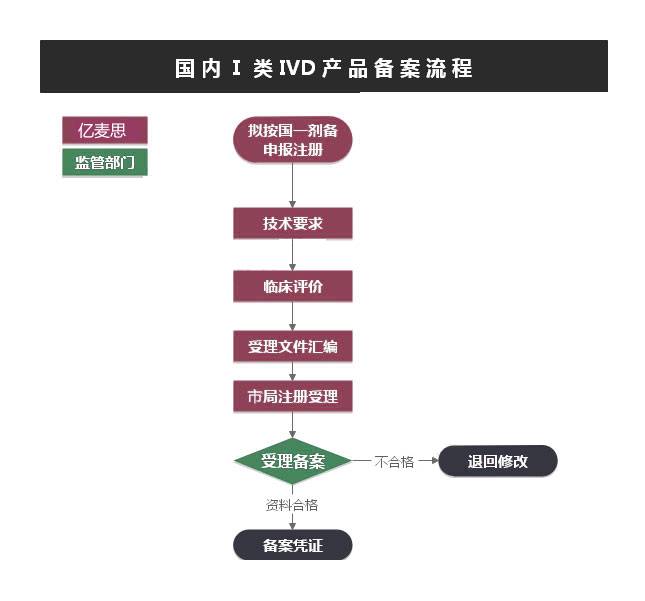
立项阶段
预算、合同、考虑期,0.5个月。
申报前资料准备
资料提供
产品技术要求编制
产品自测/委托检测
产品备案资料编写(含临床评价资料)
2-3个月
申报后
产品备案受理,备案凭证 1天
*补正资料:若资料不齐全,须补正后再受理
预算合计
4个月
I类IVD NMPA国内产品备案服务
I类IVD NMPA国内临床评价资料撰写服务
I类IVD NMPA国内医疗器械生产备案咨询服务
I类IVD NMPA生产备案咨询服务