
汇聚亿万资源,
拥抱星辰大海!
公司全称:湖南省国瑞中安医疗科技有限公司
咨询热线:400-606-1175
公司地址:湖南省长沙市芙蓉区朝阳街道湖南文化大厦B座1902房

客服微信
版权所有:Copyright © 湖南省国瑞中安医疗科技有限公司 All Rights Reserved 湘ICP备2023031193号-1 技术支持: 湖南好测信息科技有限公司
CRO一站式服务
在湖南国瑞中安
发布时间:2022/01/07
澳大利亚:病例急增、试剂盒快用完了……
.png)
由于Omicron变异毒株的出现,澳大利亚新冠患者日益增加,据澳大利亚广播公司(ABC)消息,澳大利亚政府承认,目前该国确实存在快速检测工具短缺的问题。如今澳大利亚民众一直难以及时地得到新冠检测,在一次又一次被人满为患的检测点拒之门外后,不少民众放弃了PCR检测,转而购买检测速度更快的快速自测抗原测试。
现在,各零售商提供的自测试剂盒也被卖光,仅有少数大幅加价的检测盒在售。
11月1日起澳人将能在家自测新冠!
目前新冠家用自测试剂在澳洲仍有大量需求,TGA局长John Skerritt教授表示,他们已经提出建议,11月1日起,允许澳大利亚人在家进行新冠的核酸测试。届时,大家可以通过网络、药店、便利店,以及任何他们想要的渠道购买到自测产品。
TGA(澳大利亚药品管理局)也于近日发布通知,自11月1日起,新冠抗原快速自测试剂盒需要TGA 批准并获得ARTG(澳大利亚医疗用品注册登记)即可在当地出售供家庭自测使用。
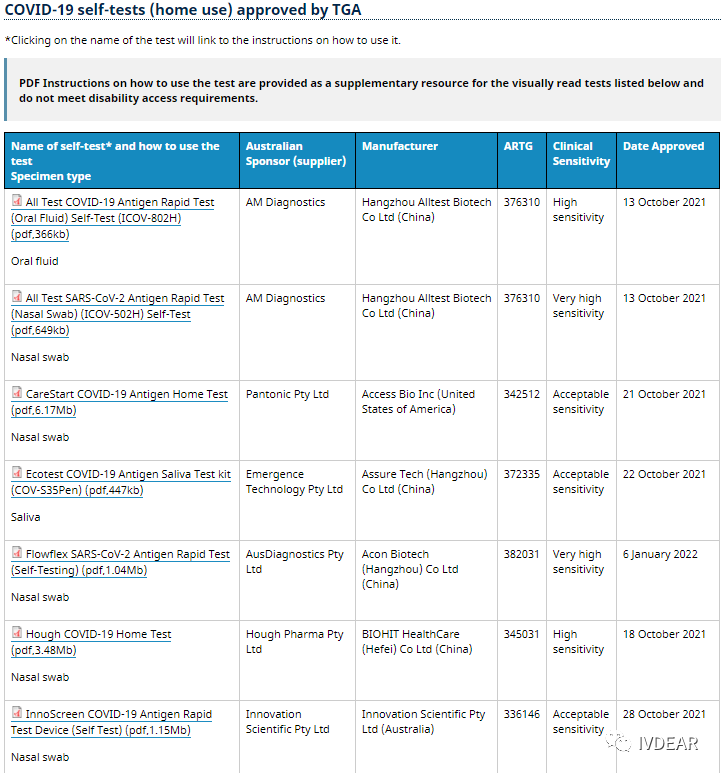
在TGA官网上,我们可以看到,目前第一批拿到澳大利亚抗原家用自测试剂准入的有多家中国企业。*早获批的企业是半个月前才获得的批准,**获批的则是11月3号。对于想要进入澳大利亚市场的IVD国内企业来说,获得TGA审批,便可快速入场 。
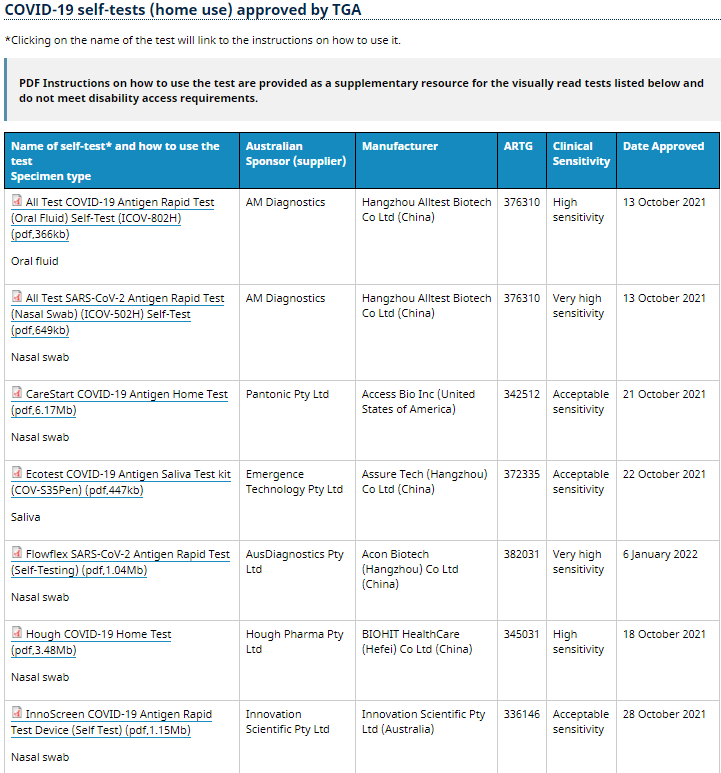
(查看更多获批清单可在TGA官网查询)
截止2022年1月6日,已有十几家企业的新冠抗原自测产品获得澳洲药品管理局TGA批准,有意向的企业可向TGA提交申请注册(TGA认可欧盟CE认证,如已获得公告号自测ce认证的企业更容易申请)。
TGA还公布了《抗原快速自测的性能要求和降低风险策略指南》、《用于抗原快速自测的软件监管要求指南》,对新冠抗原自测试剂的准入提出了详细的要求和指引。
TGA在ARTG中提出了供应新冠抗原自测试剂的10项必须条件。这些强制性的条件涉及以下几个方向的内容:
1.用户支持服务
2.使用说明书
3.临床研究
4.投诉
5.上市后监管报告
TGA对COVID rapid antigen self-tests的性能要求与世卫组织WHO和欧盟委员会发布的技术规范保持一致。
临床要求:临床敏感性 ≥80%(对于在症状出现后7天内收集的样本);临床特异性≥98%
此外,在TGA发布的Performance requirements and risk mitigation strategies指南中提到了关于无症状筛查,对于无症状个体表现的研究,建议连续采集无症状阳性标本至少20份,连续采集阴性标本至少100份。所有标本都应采用RT-PCR检测。应对所有不一致的结果进行差异分析。
指南中还提到可用性研究,应包括至少100名参与者,以检查其可用性特征,并在实际使用环境或模拟环境中进行,监督但不干预的观察员。整个工作流程应由参与测试的每个个体执行,包括样本收集、测试和结果解释,而不需要研究观察员的协助或指导。
制造商不需要提供澳大利亚特有的可用性研究,也就是说可以不要求澳洲本土标本。
国瑞中安为各大企业专项提供欧盟CE、澳洲TGA、common list互认清单、前瞻性实验、欧代CE注册、Omicron、delta、临床及非专业人士可用性实验等服务。