|临床监查
-
临床监查介绍
医学监察是什么?医学监察是临床研究过程中监查工作的重要组成部分,与临床监查、数据监查及安全相互补充,验证并确保受试者的权利和福祉受到保护,试验数据质量符合方案、GCP和其他监管要求。医学监察员,也叫临床监查员(CRA),不仅需要有专业知识基础,也需要熟悉适当的法律法规,具有数据管理、分析与总结的能力,还需要具备项目管理,团队合作,沟通谈判的软实力。
依据《医疗器械临床试验质量管理规范》第一条的规定,临床试验监查的目的是为了加强对医疗器械临床试验的管理,在维护医疗器械临床试验过程中受试者权益,保证医疗器械临床试验过程规范,结果真实、科学、可靠和可追溯的前提下,督促临床试验顺利完结。
湖南国瑞中安第三方临床试验稽查公司,拥有专业的稽查和培训团队,建立了一整套医疗器械临床试验监查和培训的全面的标准操作规程。本监查专项服务涵盖需临床的医疗器械产品和IVD体外诊断试剂产品,通过项目稽查、提供咨询和培训,确保参与临床试验的各个机构都能按照GCP(或ICH-GCP)、标准操作规程(SOP)和相关法规要求实施临床试验。
在国内临床试验质量普遍堪忧的今天,独立的第三方监查代理公司的出现具有重大意义
1、监查公司的专业团队可弥补临床试验机构的不完善;
2、监查公司的独立性可以监督CRO公司的临床试验质量;
3、监查公司的专业团队可以为医药企业提供专业的技术咨询服务。
这就是湖南国瑞中安在公司成立之处,设立临床试验稽查团队的初衷。
湖南国瑞中安提供的临床监查员工作有哪些?
临床监查员的工作可以涵盖整个临床试验,即从方案设计开始到研究总结报告完成。大部分工作涉及研究相关问题和方案问题。例如:
1、回答研究中心、CRA和研究团队的入排标准问题;
2、在研究开展过程中回答关于研究方案的问题;
3、与研究中的其他人员协调,以确保信息的一致性;
4、解决来自研究中心和研究团队在整个研究中的安全问题;
5、在受试者因医疗紧急情况需要揭盲时确认并提供指导;
6、审核事件编码列表;
7、研究与方案相关的培训。
临床试验监查的最佳时间点
临床试验入组20%病例(及早发现问题,通过加强培训,避免问题再次发生);
最后一例受试者出组(在收表前发现问题,避免过多的统计学答疑);
总结报告生成后,临床总结会之前(总结报告、统计分析报告与原始资料的数据不一致是常见问题)
项目经理、协调员和监查员是临床试验中最为关键的三个角色,临床监察员代表的是申办方的利益,湖南国瑞中安坚决维护申办方的利益,我们为受试者负责,也为申办方临床项目负责。湖南国瑞中安承诺,我们的监查员重视审核签名页,确保数据的真实、准确、完整,绝不弄虚作假。
-
服务流程
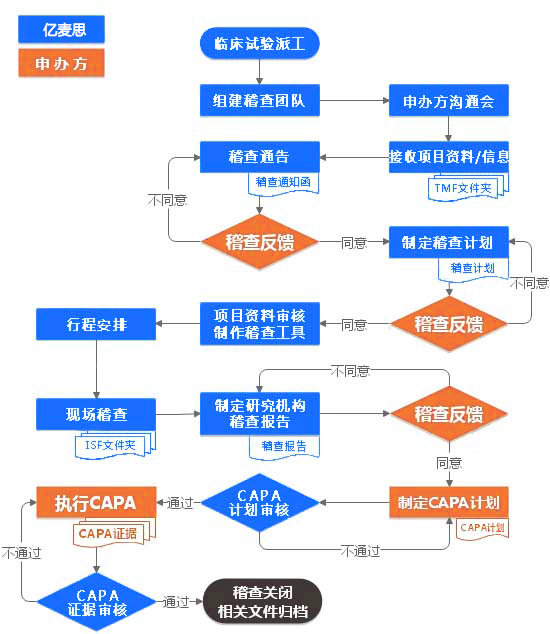
-
官方收费
监查费用由第三方临床监查服务商收取,官方不收取费用。
医疗器械临床试验监查收费标准
需做医疗器械临床产品类别
CRA收费标准
二类器械
600-800元/例
三类器械
1200-1500元/例
具体报价,依据样本收集难易程度、项目难易程度等因素判定,有可能高于上述费用。
-
基础法规
文件名称 文号 发布时间 实施时间 《医疗器械监督管理条例》
650号文件
2014-3-7
2014-6-1
《医疗器械注册管理办法》
药监总局令4号
12014-7-30
2014-10-1
《医疗器械临床试验质量管理规范》
药监总局令25号
2016-3-23
2016-6-1
-
医疗器械临床试验监查服务周期
阶段 说明及时限 稽查准备至现场稽查开始
收到项目资料后1个月内
现场稽查
SDV抽样下,2个WD/家
稽查报告
最后一家机构现场稽查完成后3个WD
CAPA计划审核
CAPA计划获得后2个WD
CAPA证据审核
CAPA证据获得后2个WD
-
医疗器械临床试验监查相关服务
服务项 具体工作内容 第三方独立监查
1、调研、选择、提供试验中心和研究者相关信息;
2、获得临床文件及伦理委员会批件,对伦理会批件初审;
3、组织研究者会议作会议记要,接待研究者工作;
4、严格按照GCP、SOP、试验方案和法律、法规,按时完成研究中心的选择、启动、常规监查、和中心关闭;
5、高质量的研究中心访视报告;
6、协助研究中心进行AE/SAE的报告,跟踪随访;
7、核查知情同意过程,确保受试者安全及利益;
8、原始数据核查,对各类数据负责;
9、试验器材文件管理;
10、稽查前工作准备,稽查报告反馈、整改。
CAPA计划可行性审核
CAPA证据有效性审核



